
Entre la precaución y la esperanza: terapia génica y edición genética en la distrofia muscular de Duchenne

El impacto de las enfermedades musculares en la educación y el empleo de pacientes y familiares
Sobre la distrofia muscular de Duchenne
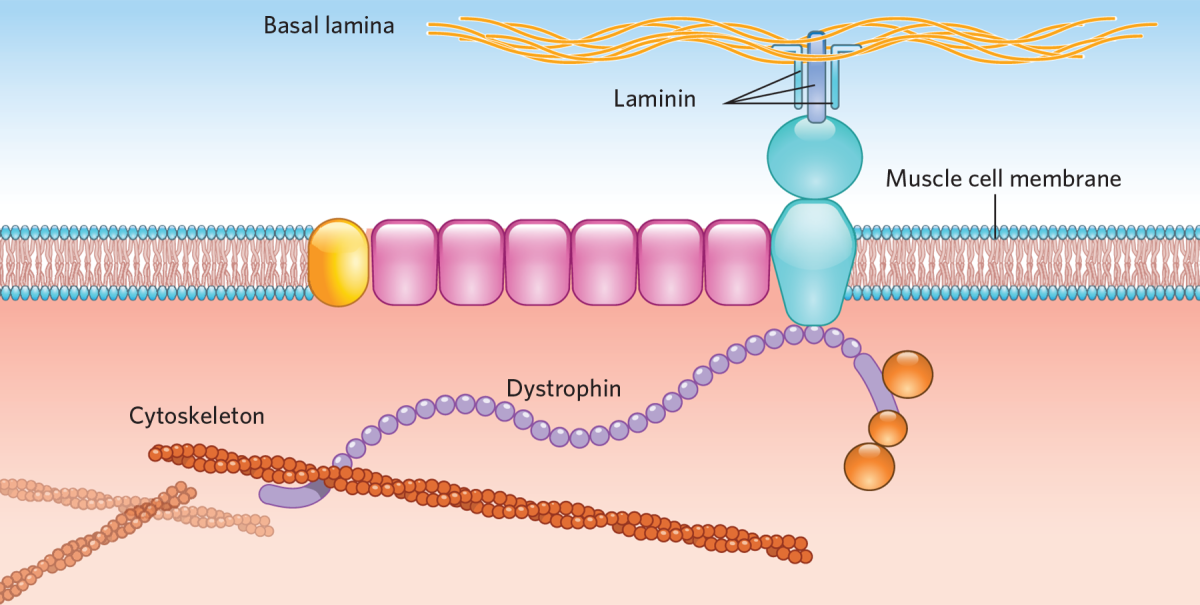
La distrofia muscular de Duchenne (DMD) es la forma más común de distrofia muscular, y afecta a alrededor de 1 de cada 5.000 recién nacidos en todo el mundo. La característica principal es una pérdida progresiva de la función muscular, que eventualmente conduce a una pérdida de la función respiratoria y cardíaca. La DMD es causada por mutaciones en el gen DMD. Esto genera la ausencia de la proteína distrofina, que juega un papel fundamental en las células musculares. Sin distrofina las células musculares se dañan con facilidad, lo que lleva a la pérdida de estas células y, por lo tanto, a la función muscular.
Tratamiento
Actualmente, el tratamiento principal para la DMD son los corticosteroides, que no curan la enfermedad pero retrasan su progresión. Eso sí, los corticosteroides no recuperan la distrofina perdida. Actualmente se investigan varios enfoques para restaurar parcialmente esta proteína. Hasta el momento se han aprobado cuatro medicamentos que tienen efectos moderados y solo son adecuados para grupos específicos de pacientes: el compuesto translarna (EMA, Europa), que facilita la lectura del ARN mensajero (ARNm) con codón de parada prematuro, y los compuestos de omisión de exón eteplirsen y golodirsen (FDA, EE. UU.) y viltolarsen (MHLW, Japón).
Otras terapias que reemplazan o restauran la distrofina en diferentes etapas del desarrollo son la terapia génica y la edición genética. No son una cura definitiva pero, al igual que los medicamentos que facilitan la lectura del ARNm con codón de parada prematuro o la tecnología de omisión de exones, tienen como objetivo produccir de una distrofina parcialmente funcional. Esto puede disminuir pero no detener la progresión de la enfermedad, y ciertamente no puede revertir la pérdida de tejido muscular. Todavía existen varios obstáculos que deben superarse antes de que estas terapias puedan llegar a la clínica.
Terapia génica en la DMD
El objetivo de la terapia génica es introducir un gen corregido en las células musculares para permitir la producción normal de distrofina.
Existen actualmente varias problemáticas que superar antes de que podamos emplear este enfoque para tratar la DMD. En primer lugar, una gran parte de nuestro cuerpo (30-40%) contiene músculos, y cada uno está formado por miles de millones de células musculares, que a su vez contienen miles de millones de núcleos, en los que se encuentran los genes. Para que la terapia génica pueda tener algún efecto, deben alcanzarse una gran proporción de estos núcleos y la llegada del gen correcto a todos estos núcleos es un problema. Por lo general, se emplean vectores virales inactivados, pero el único vector que puede infectar eficazmente el músculo es el virus adenoasociado (AAV). Como los AAV son muy pequeños y el gen de la distrofina es grande, este no cabe. Por lo tanto, se utilizan microdistrofinas, proteínas que contienen solo parte de los segmentos de ADN importantes para su función. Sin embargo, aún no se sabe con seguridad qué tan funcionales serán estas microdistrofinas en los pacientes.
Otro problema es que, debido al turn-over de las células musculares (este término hace referencia a la renovación o reemplazo continuo de proteínas en el organismo), los genes se irán perdiendo con el tiempo y, por lo tanto, la producción de distrofina disminuirá. Lamentablemente solo es posible que estos pacientes reciban el tratamiento una sola vez, ya que a partir de entonces estos adquieren inmunidad ante los AAVs. Además gran parte de la población ya posee anticuerpos AAV, por lo que no podrían recibir el tratamiento. Otros desafíos son que, en este momento, la fabricación de estos complejos a gran escala es difícil y se sabe poco sobre la seguridad a largo plazo de los AAVs.
Actualmente están en curso algunos ensayos clínicos a pequeña escala, los cuales han mostrado varios problemas. En el primer ensayo se observó muy poca producción de microdistrofina, por lo tanto, se usaron dosis más altas en ensayos posteriores. Dado que se desarrollaron efectos secundarios graves, algunos de estos ensayos se suspendieron temporalmente.
Edición genética
En la edición genética se corta o elimina una pequeña parte del ADN del gen mutado. Al igual que la técnica de omisión de exones, esto permite que la traducción del gen continúe y se produzca una proteína funcional. Para esto se requiere un sistema de dos componentes: se utiliza una guía, CRISPR, que dirige a Cas9 (la enzima que corta el ADN) a la ubicación específica en el ADN donde debería cortar. A diferencia de la omisión de exones, que ocurre a nivel de ARN y por lo tanto es transitoria (el ARN es una copia temporal del gen, producida cuando se necesitan fabricar proteínas), la edición del genoma ocurre a nivel de ADN, por lo que es permanente. Por lo tanto este enfoque, al contrario la omisión de exones, solo requeriría de un tratamiento.
Hasta ahora la edición genética solo se ha probado en modelos de ratón, no en pacientes, y aún quedan muchas preguntas por resolver. En primer lugar, también es un problema la llegada al músculo. Se pueden emplear AAVs, pero dado que se trata de un sistema de dos componentes ambos no caben en un solo AAV, por lo que se necesitarán dos AAVs. Esto significa que tienen que llegar a la misma célula un AAV que contenga CRISPR por un lado, y un AAV que contenga Cas9 por otro, lo que dificulta en gran medida la eficiencia de la técnica.
Varias de las problemáticas de la terapia génica también aparecen aquí. En la edición genética el efecto también se perderá con el tiempo, el re-tratamiento no es posible y muchos pacientes ya tienen anticuerpos AAV preexistentes. La fabricación a gran escala también es un inconveniente.
Por otro lado, también hay preocupaciones sobre la seguridad a largo plazo del uso de AAV. Además, si el CRISPR no es específico sino que también se une a otros lugares en el ADN, podrían inducirse otros cambios permanentes en el ADN que podrían ser dañinos. Por otro lado, la edición genética, al igual que la omisión de exones, es específica de la mutación, lo que significa que no será adecuada para todos los tipos de mutaciones y se deben desarrollar diferentes compuestos CRISPR para diferentes mutaciones.
Para más información sobre las posibilidades y los problemas de la edición genética, haz clic aquí.
